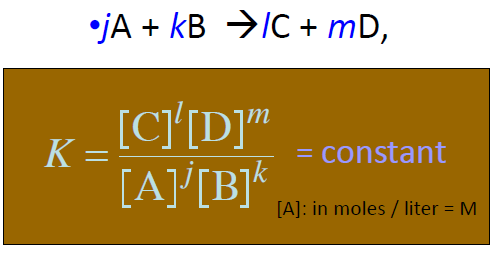[일반화학] Lec 08 - Chemical Equilibrium
[일반화학] Lec 08 - Chemical Equilibrium
Chemical Equilibrium
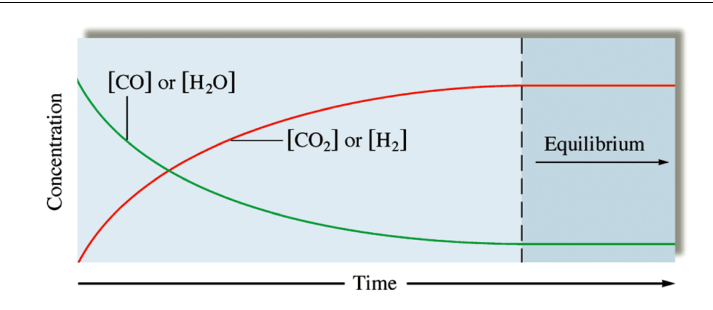
- 농도 변하는 부분 : Potentially reversible 하지만 실제로는 irreversible
- 평형 도달 : Foward, Reverse 반응의 반응속도가 동일할 때 평형에 도달했다고 간주
- 평형상태에서 반응속도가 0인 것은 아님. 정, 역반응의 생성속도가 동일해 평형상태에 도달한 것 처럼 보임(동적 평형)
평형 상수 (Equilibrium Constant)
- 평형상수 = 평형에서의 농도의 계수 제곱의 비 (몰농도 단위) 온도에 대한 Term이므로 온도도 기입.
- Kc (농도 평형상수), Kp (압력 평형상수) 는 관계 있으며, $RT^n$배, n=반응물 계수합 - 생성물 계수합
- 왜 저런 식이 나왔냐 : 열역학적으로 Gibbs Free Energy가 다른 pressure에서 어떻게 되는지를 정리하면 됨. (기체)
Solid, Liquid에서의 Equilibria
- 고체, 액체의 경우 몰농도에 비례하는 Term이 아님. 항상 1로 일정. (포함시키지 않는다고 생각)
수용액에서의 G 값의 계산
\[G_{A(aq), m}(p) = G_{A(aq), m}^0 + RTln({[A]\over c_0})\]- Pure 한 상태의 증기압 평형 :
- Impure 한 상태의 증기압 평형 (pure 한 상태보다 증기압 감소)
- 정리하면 : $G_{A, m} (l) = G_{A, m}^* (l)+RTln(\chi_A)$
- 순수한 수용액과 용액의 Gibbs Free Energy 차이는 RTln 몰분율
Q : Reaction Quotient
- Q < K : 정반응
- Q = K : 평형
- Q > K : 역반응
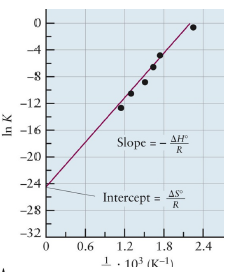
Van’t Hoff Equation
\[ln(K(T)) = -{\Delta H_{rxn}\over R} \cdot {1\over T} + \text{const}\]- 기울기에 $ΔH_{rxn}$ 이 포함되어 있으므로, 발열일 경우 slope 양수, 흡열일 경우 slope 음수
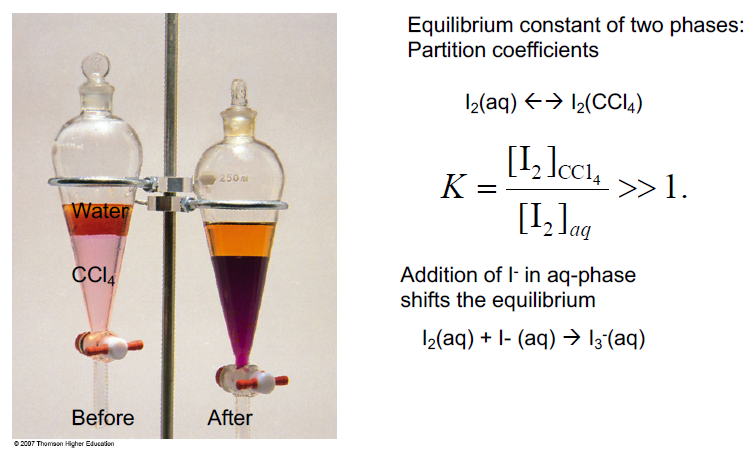
용해도 차이를 이용한 추출
This post is licensed under CC BY 4.0 by the author.