[일반화학] Lec 01 - Fundamentals
[일반화학] Lec 01 - Fundamentals
원자 구성요소의 발견 역사
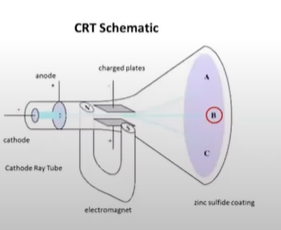
전자의 발견
- 음극선에 전압을 걸어 원자가 전자와 다른것들로 이루어졌다는 사실 발견
- 음극선의 전하 부호 확인 : 전기장을 인가하여 +극쪽으로 쏠림
- CRT schematic : 음극선의 방향, B, E의 방향이 서로 직교하도록 하여 전자가 직진하도록 함.
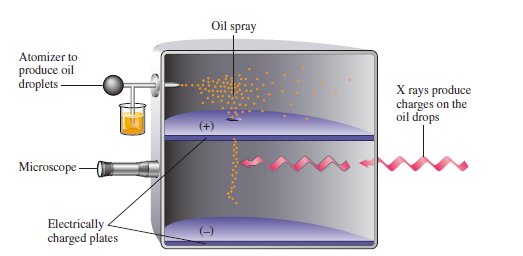
전자 전하(비전하)의 정량적 측정
- 밀리컨의 기름방울 실험 : 기름방울을 분사하여 전기장이 있는 판 속에 넣음
- X-Ray에 의해 기름방울에 전하가 대전됨.
- Mg=QE라는 식에 의해 모든 전하량 Q는 기본전하량 $1.602 × 10^{-19}C$의 배수라는 사실 확인함. 즉 전자의 전하량을 구함.
원자핵에 관한 가설 : J.J Thomson’s ‘plum pudding model’
- 전자는 발견됨, 원자가 중성이므로 (+) 전하를 띈 원자핵을 생각하면서, 푹신한 (+)극 띈 원자핵에 -극 띄는 전자가 박혀있다고 가설 세움
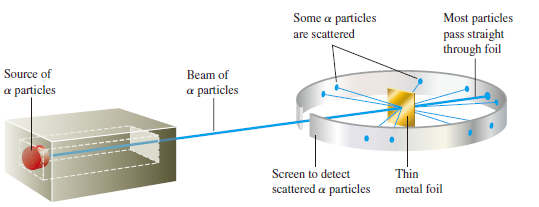
러더퍼드의 알파입자 산란실험
- 알파입자(헬륨 원자핵)을 얇은 금속박에 산란
- 극히 일부의 알파입자가 산란, 혹은 되튕겨져 나옴
- 원자에서 원자핵이 차지하는 부피는 극히 적고, 밀도는 매우 크다는 사실을 알게 됨
현대의 원자론
- Atom Contains
- electrons
- protons : 질량은 electron과 거의 10000배 가량 차이가 남 / $H^+$을 의미.
- neutrons : no electrical charge / neutron이 미세하게 proton보다 질량이 큼
원자론 개요
원자의 표기법
\[{}^Z _AX\]- A : Mass number, 중성자 + 양성자의 수
- z : Atomic number, 양성자 수
- X : Element Symbol, 원소기호
동위원소 (isotope)
- 양성자수, 전자수는 같으나 중성자수가 다름. 화학적 성질은 거의 대부분 같고, 이동특성이 다름.
- 구별이 안되므로 고르게 존재한다고 봄.
- 수소 : 중수소-Deuterium, 삼중수소-Tritium
- 탄소 : Carbon-13 / 탄소 동위원소 측정법 (1:99)
- 태양 복사에 의해 지표 상에서는 비율이 유지,
- 유기물 내부에서는 비율이 점차 감소.
원자 질량의 정의 (Atomic Mass Unit, AMU)
- Carbon-12의 질량을 12amu로 정의.
- ex) Carbon-13의 경우 중성자가 1개 더 많으므로 13.003355amu임.
- 원자의 평균 질량은 자연에서의 분포 비율을 곱하여 가중평균으로 나타냄.
- ex) Carbon의 평균 질량은 98.89% x 12 + 1.11% x 13.0034 = 12.01 amu
- ex2) Br : $^{79}Br : 50.7\% \ ^{81}Br : 49.3\%$ 이므로 Br의 원자량은 80이라고 함.
This post is licensed under CC BY 4.0 by the author.